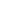药物递送技术使许多药物产品的开发成为可能,通过增强治疗药物对其目标部位的递送,最大限度地减少目标外积累,从而促进患者依从性,改善患者的健康。随着治疗方式从小分子扩展到包括核酸、肽、蛋白质,抗体和活细胞,药物递送技术也被调整以应对出现新的挑战(图1)。

图1. 治疗分子和递送技术的分类
药物递送技术的发展可以用不同的方式来描述,例如,治疗的类别和递送模式。图2为通过使用FDA批准的产品引入的新技术来回顾了药物递送系统的里程碑式的发展史(图2)。从 Spansule® 口服控释制剂到用于COVID-19疫苗递送的脂质纳米颗粒制剂,药物递送系统的发展。1950-1970年代的24小时释放口服控释制剂,随后是1990年代的24周注射长效制剂和2000年代的纳米药物。过去七十年取得的技术进步为未来几十年进一步开发新技术奠定了基础。

图2. 根据FDA批准的产品回顾药物递送技术的发展史

图3. FDA批准的可注射长效PLGA制剂发展史
所有产品均基于微粒、原位成型植入物和固体植入制剂。
1990年第一种聚乙二醇化(PEG)蛋白质Adagen®的问世标志着聚乙二醇基化药物的新纪元,图4显示了FDA批准的聚乙二醇化蛋白药物的发展史。在过去的30年里,已经开发了大约20种聚乙二醇化蛋白药物配方。聚乙二醇化是一种将聚乙二醇附着到蛋白质分子上的过程,从而减少网状内皮细胞的摄取和蛋白质降解,增加了蛋白质在血液中循环的时间,免疫原性反应也大大降低。聚乙二醇化还通过减少与靶部位的结合来降低蛋白质药物的生物活性,但循环时间越长,治疗效果就越好。聚乙二醇化技术的意义不仅仅在于增加修饰蛋白质的循环时间,从1995年的Doxil®(聚乙二醇化脂质体递送阿霉素)批准开始,它在脂质体制剂中的应用是其他重要制剂的开端。含有聚乙二醇化脂质的脂质纳米粒在2018年成功地传递了寡核苷酸,例如Onpattro®(聚乙二醇化脂质纳米粒中的siRNA)。聚乙二醇化的脂质纳米粒还被快速开发基于mRNA的新冠肺炎疫苗,例如Comiranty®(新冠肺炎疫苗,Pfizer/BioNTech)于2021年8月获得FDA的全面批准。聚乙二醇化也被用于修饰小分子。2014年批准的Movantik®是一种聚乙二醇化的α-naloxol的衍生物,可以减少血脑屏障的转运,以防止中枢神经系统的副作用。
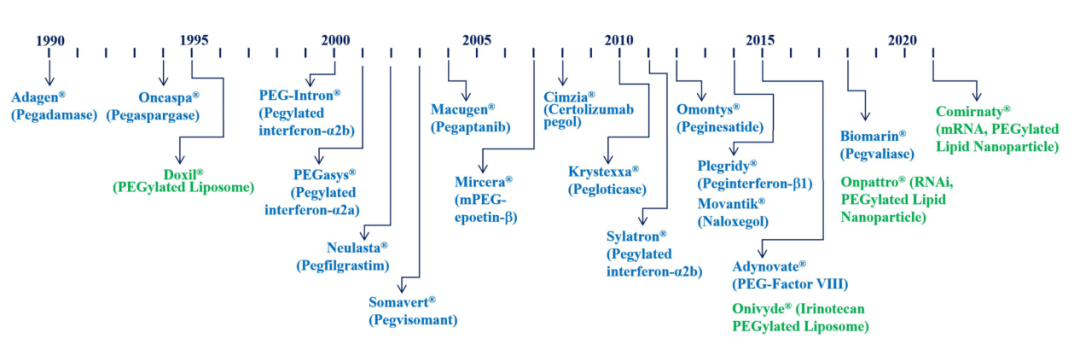
图4. FDA批准的聚乙二醇化蛋白药物发展史
2000年美国政府发起了国家纳米技术倡议,世界其他国家也很快效仿了这一倡议。它在药物发现和传递领域的应用被称为纳米医学。从一开始,纳米医学领域几乎完全集中在肿瘤靶向药物递送上。Mylotarg®、Doxil®和Abraxane®(2005年批准的白蛋白-紫杉醇复合物)已成为纳米药物的代言人。Doxil®和Abraxane®的批准主要是基于减少副作用,而不是基于药物的卓越疗效。纳米医学研究的另一个关键改进是操纵脂质分子结构,以更有效地逃离内体。成果之一是使用脂质制剂用于传递siRNA的Onpattro®的获批。Onpattro含有一种可电离的阳离子脂质,它针对RNA封装和细胞内传递进行了优化,以及含有PEG的脂质,可以调节纳米颗粒的大小。尽管纳米医学领域在开发肿瘤靶向给药系统方面进展缓慢,但在此期间开发的技术是目前新冠肺炎的mRNA疫苗超高速发展的根本原因。从公布SARS-CoV-2基因序列到启动mRNA疫苗的临床试验,仅用了两个月的时间,以便在2020年便交付新冠肺炎疫苗(图5)。图6总结了数十年来纳米医学研究对新冠肺炎mRNA疫苗的贡献。

图5.新冠肺炎mRNA疫苗的研发时间表

图6. 纳米医学在新冠肺炎疫苗快速发展中的贡献
近年来,外泌体已经成为一种新型的药物递送的载体引起了人们的关注,其可以用来递送核酸、蛋白质和小分子药物等。作为运送载体,外泌体将其有效载荷运送到靶细胞或组织,并减少MPS介导的清除。此外,siRNA可以通过外泌体通过血脑屏障传递到中枢神经系统(图7)。到目前为止,已经使用外泌体递送药物治疗几种潜在的疾病,如不同类型的癌症、心血管疾病、帕金森氏症和阿尔茨海默病,以及其他神经退行性疾病。

图7. 外泌体作为一种新型的药物递送载体的优势
慢性疾病及长期治疗
随着平均寿命的延长,慢性病患者需要花费更多的时间进行进一步长期治疗的。10种最常见的慢性病包括高血压、高胆固醇、关节炎、缺血性心脏病(或冠心病)、糖尿病、慢性肾病、心力衰竭、抑郁症、阿尔茨海默病和痴呆以及慢性阻塞性肺病。一天吃一次药可能不够方便,更别提一天吃几次了。对于很多终生要吃药的老人来说,一天一次,甚至一个月一次,可能都不够方便。
在美国,60%的成年人患有慢性病,40%的成年人患有两种或两种以上的疾病。治疗慢性疾病需要多年的持续医疗看护和干预。然而,即使在发达国家,对长期治疗的依从性平均为50%。坚持长期治疗需要的不仅仅是服用处方药。它还包括许多治疗行为,包括寻求医疗护理、开处方、适当服药和参加后续预约复查等。在这里,长效制剂无疑有助于提高患者的依从性和便利性,尤其是长效注射制剂,可提供数周和数月的每日剂量。
自1989年推出第一个长效注射剂以来,只有大约 20 种药物被制成长效注射剂,有效期长达 6 个月。每个配方的持续时间将超过目前设定的6个月。尽管如此,长期给药还取决于每种药物的日剂量、药物稳定性和治疗指数。
长效制剂还包括其他制剂,例如需要手术植入体内并移除的的装置,除非该制剂设计用于生物降解。如果药物释放多年,手术植入装置可能是必需的,但Norplant® 是一种可释放药物5年的避孕装置,由于无法移除,不得不从市场上退出。因此,使用可生物降解的聚合物优先用在这类不可降解的制剂。
小分子药物和生物制剂
表1显示了2010年美国和2015年与2020年全球最畅销的20种药物。大多数药物长期用于治疗慢性疾病。表 1 中的药物清单显示,生物制剂的数量在过去十年中显著增加。根据EvaluatePharma的报告,2010年生物制剂仅占100强产品的34%。其份额在2018年逐渐增加到53%,并在未来几年保持在50%左右。这清楚地表明,未来的药物将是小分子和生物制剂的等量混合物。目前,大多数生物制剂通过注射给药用于短期递送。我们有必要开发长效注射制剂,可以将药物递送数周和数月,以提高患者的便利性和依从性。

靶向给药
靶向给药的概念需要澄清,因为它对不同学科的科学家有不同的含义。Paul Ehrlich 的魔术子弹(靶向药物)最初是指抗毒素或抗体具有选择性靶向细菌而不影响其他生物体。在这里,选择性靶向仅仅意味着“选择性杀死”细菌。抗体仍然分布在全身,但选择性地与靶标相互作用。我们用的大多数药物主要与靶标相互作用,但它们也与正常细胞相互作用,产生副作用。因此,魔术子弹的概念并不意味着抗体或药物分子只针对靶标。
当前使用纳米药物进行靶向给药的概念已经演变成与最初的魔术子弹概念完全不同的东西。如今,如果纳米药比对照(通常是药物溶液)递送更多药物到靶向肿瘤,则使用术语“靶向药物递送”。所有的抗癌药物仍然对正常细胞有害,因此,在不影响正常细胞的情况下使用“靶向给药”的想法并不可行。此外,将药物或纳米颗粒递送至实体瘤还不够,因为药物必须通过肿瘤微环境扩散并进入肿瘤细胞才能发挥作用。因此,将药物递送至靶标部位不一定与功效相同。然而,使用纳米药进行靶向给药的概念已经深入到该领域,而且未来需要改变这一点,以制造真正的靶向给药系统。
靶向药物递送在基因治疗中是必不可少的。如果特定基因进入非靶细胞,副作用肯定也会随之而来。在基因治疗的早期,甚至目前的临床基因治疗试验中,一些志愿者因失活的腺病毒载体意外运送到错误的地方而死亡,这些载体仍然可以刺激免疫反应。同样的问题在2021年仍然存在:患者在基因治疗试验期间死亡或患上癌症。虽然基因疗法和细胞疗法安全性和有效性将继续得到提高,但它们将面临小分子疗法的激烈竞争,小分子疗法总是更容易生产和递送。重要的是要记住Ehrlich的格言,即科学的成功需要四大G:“Geduld、Geschick、Glück、und Geld”(耐心、聪明、运气和金钱)。虽然 mRNA 疫苗的开发是以“曲速”进行的,但我们不一定要得出结论,所有疗法都将遵循同样的速度,并继续记住和练习四个G。
克服生物屏障
对于药物递送科学家,生物屏障是一个麻烦。没有生物屏障,药物递送会容易得多。同时,我们都知道生物屏障对于保护我们免受有害物质的侵害至关重要。生物屏障可分为上皮屏障和内皮屏障。上皮屏障包括黏膜组织(例如角膜、鼻子、胃肠道和肺)和表皮。内皮屏障,例如血脑屏障,由内皮细胞膜、紧密连接、顶端表面糖被和基底膜组成。
多年来,我们已经提出了各种方法来克服生物屏障,并且许多方法已经显示出可以增加药物的吸收。然而,更高的药物生物利用度伴随着巨大的代价。一旦生物屏障被破坏,不仅有益药物,而且所有病原体都会一起进入系统。迄今为止,还没有克服生物障碍的“安全”方法。我们有必要将小动物实验中克服生物障碍的潜力与临床应用区分开来,这需要明确证明其安全性和有效性。
口服给药:从小分子到多肽药物
口服给药是最方便、应用最广泛的给药方式。口服药物递送具有制剂障碍,例如低水溶性和低稳定性,以及生物屏障,特别是短的胃肠道转运时间、低渗透/吸收和系统前清除率。开发生物药剂学分类系统是为了说明对药物生物利用度、水溶性和渗透性至关重要的两个关键药物特性。为了克服胃肠道运输时间短,制剂科学家开发了各种胃滞留制剂,包括浮动、粘膜粘附、可膨胀、高密度系统、超多孔水凝胶、磁性系统和可展开/可扩展设计。虽然,胃的生理差异,包括胃的pH值和运动性,可以在很大程度上影响吸收和停留时间,从而影响最终的药代动力学特征。尽管如此,真正的胃滞留系统仍有待开发。
胃肠道旨在吸收小分子,如碳水化合物、氨基酸和脂溶性分子。所有口服给药的药物都是低分子量药物。通过口服给药肽和蛋白质药物一直是药物递送科学家的梦想,因为它的好处是不可估量的。我们已经测试了各种方法和装置来克服肽和蛋白质药物吸收不良的问题,但都仅处于研发阶段。
口服药物递送的现实困难是肽和蛋白质药物的生物利用度非常低,以至于无论使用何种递送系统都不实用。当涉及到口服胰岛素时,困难变得无法克服。许多研究表明,胰岛素可以从胃肠道吸收并控制体内葡萄糖水平。这在老鼠身上可能是真的。但即便如此,也需要仔细剖析实验条件的细节。在给予胰岛素之前,小鼠处于禁食状态,其数量级高于人类使用的数量级。微针透皮递送系统也用于递送胰岛素,以观察血糖水平在数小时内的下降。请注意,胰岛素不是一种可以随时以任意浓度范围给药的药物。它必须在准确的时间以准确的量递送才能有效,并且它必须对血液中葡萄糖水平的波动作出反应。此外,在葡萄糖水平降低后,必须停止胰岛素释放。准时且及时递送准确剂量对于胰岛素递送显得至关重要,目前还没有药物递送系统可以满足这些要求。自我调节胰岛素输送系统的发展是药物递送的终极目标之一。
口服给药一直是最首选的给药途径。然而,我们需要进一步了解对口服吸收重要的过程,例如个体差异、不同性别和年龄之间药物吸收的差异、胃潴留和制剂限制(水溶性差的药物和渗透性差的药物)。
血脑屏障
血脑屏障(The blood-brain barrier, BBB)一直是治疗中枢神经系统疾病的主要障碍。为了克服BBB,我们已经开发了各种药物递送系统,例如腺相关病毒载体、病毒模拟纳米颗粒、红细胞模拟纳米载体(红细胞膜包被的纳米载体)、基于细胞的递送纳米载体、细胞穿透肽连接纳米载体、细胞外囊泡、可注射水凝胶、紧密连接调节剂和免疫调节剂。虽然大多数已经在小动物模型中显示出疗效,但离临床应用还很遥远。令人鼓舞的是,紫杉醇曲瓦肽(ANG1005,紫杉醇与 Angiopep-2 的偶联物)的II期临床试验取得成功,其通过低密度脂蛋白受体相关蛋白实现有效穿过BBB。为了证明临床安全性和有效性,我们必须解决精确剂量、脱靶效应以及扩大生产问题。
缺乏合适的BBB模型是导致阿尔茨海默病、帕金森病、多发性硬化、癫痫和缺血性中风等疾病制剂开发进展缓慢的另一个因素。缺乏合适的模型不仅限于向大脑递送药物,其他疾病模型,特别是癌症治疗也需要改进。药物还通过鼻内沉积和嗅觉和呼吸上皮吸收直接递送到大脑,从而减少全身暴露并提供更高的生物利用度。然而,这样的给药途径还需要更多的研究工作来揭示其真正的基本机制。大脑中的药物分布模式是未知的,因此很难使用仅在与特定大脑区域的特定受体结合后才有效的药物。
结语
虽然过去70年来药物递送技术的进步令人叹为观止,但它们还只是冰山一角。满足当前和未来未得到满足的需求,需要更多创新的药物递送技术,以克服现有的瓶颈,例如,改善难溶性药物的水溶性,克服生物障碍,以及开发更高效的长效制剂配方。过去学到的经验教训是开发未来用于产品的药物递送技术的重要资产。正如新冠肺炎mRNA疫苗的快速发展所表明的那样,应对未来不可预见的危机需要不断积累失败、知识和技术。如今对药物递送技术的多样化研究以往任何时候都变得更加迫切。
参考文献
1.Evolution of drug delivery systems: From 1950 to 2020 and beyond.
2.The evolution of commercial drug delivery technologies.
3.Exosome-based delivery of natural products in cancer therapy.
4.Exosome: a significant nano-scale drug delivery carrier.
声明:版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与我们联系,我们将在第一时间删除内容!